- Details
Peter Liese erhält Zusicherung von BioNTech
„Die sorgfältigere Prüfung des BioNTech-Impfstoffes wird nicht dazu führen, dass bis zum Frühjahr in Deutschland weniger Menschen geimpft werden, als in Großbritannien. Der für die EU und Deutschland bestimmte Impfstoff geht nicht nach Großbritannien. Großbritannien erhält Impfstoff für 400.000 Menschen (800.000 Impfdosen) und sobald der Impfstoff von der Europäischen Arzneimittelagentur eine bedingte Zulassung erhält, beginnt die Auslieferung für Deutschland und die anderen EU-Staaten.“ Dies erklärte der gesundheitspolitische Sprecher der größten Fraktion im Europäischen Parlament (EVP-Christdemokraten) Dr. med. Peter Liese nach Gesprächen mit der Firma BioNTech.
Sean Marett, der CCO und CBO von BioNTech, hatte Liese versichert, dass der für die Länder der Europäischen Union vorgesehene Impfstoff bereits zum Teil produziert und eingelagert ist. „Wenn die EMA die Zulassung erteilt, kann die Impfung sofort beginnen. Die Notfallzulassung in Großbritannien hat keinen Einfluss auf die Anzahl der Dosen, die in den nächsten Monaten für andere Regionen wie z.B. die Europäische Union geliefert werden. Wir gehen davon aus, dass Millionen von Bürgern in der EU im ersten Quartal 2021 geimpft werden, wenn wir dieses Jahr die behördliche Zulassung erhalten“, so Marett in einer schriftlichen Stellungnahme gegenüber Peter Liese.
Weiterlesen: Sorgfältige Prüfung in der EU führt nicht zu weniger Impfstoff
- Details
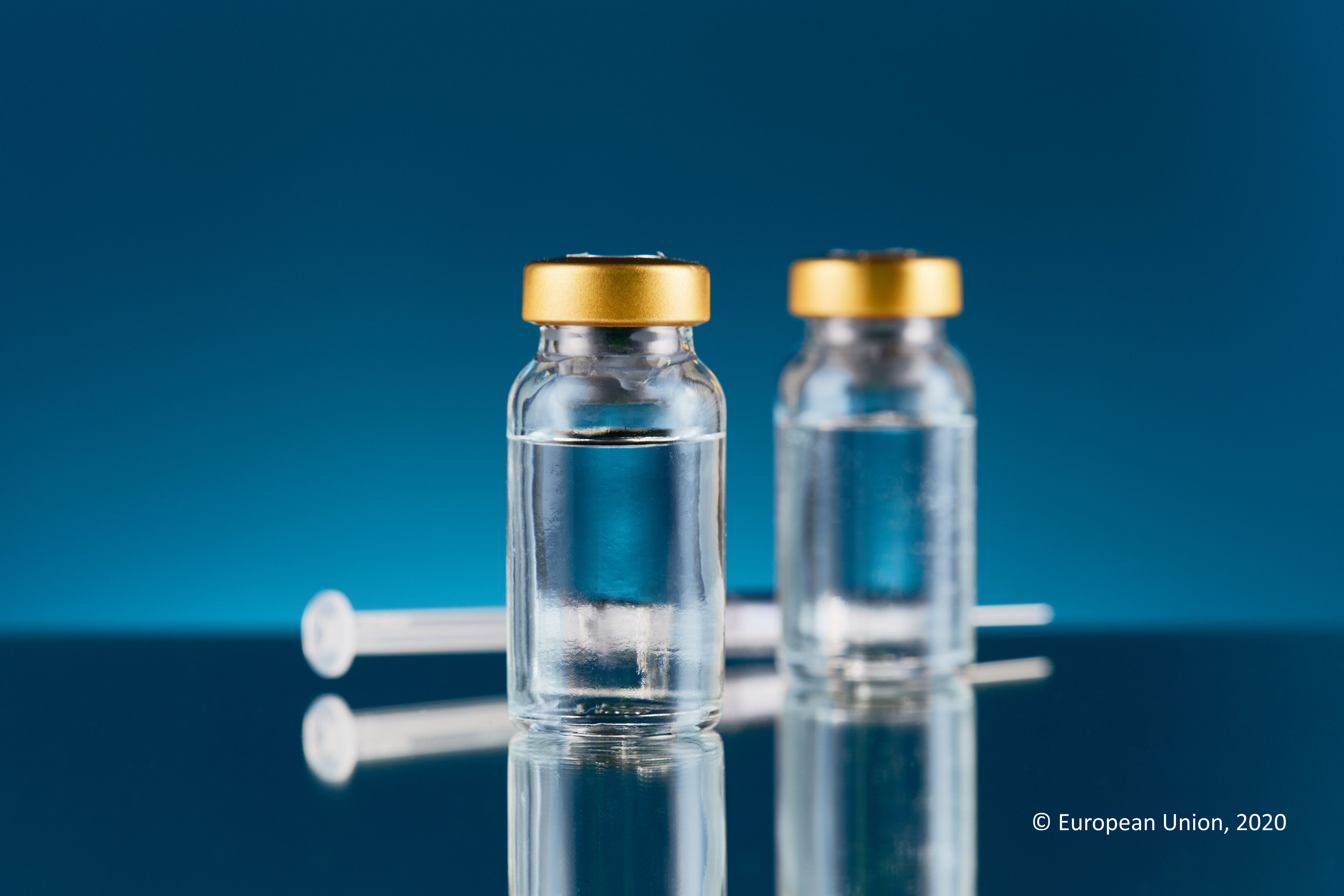
BioNTech Zulassungsantrag für Deutschland und die EU deutlich wichtiger als Moderna / Notfallzulassung in Großbritannien und den USA nicht zur Nachahmung empfohlen/ Ungarns Verhalten höchst problematisch/ Besser zwei Wochen sorgfältige Prüfung als überhastetes Inverkehrbringen
Nach dem US-Hersteller Moderna hat auch der deutsche Hersteller BioNTech einen Zulassungsantrag bei der Europäischen Arzneimittelagentur für einen Coronaimpfstoff gestellt. „Dieser Antrag von BioNTech ist für Deutschland und Europa deutlich wichtiger, weil zwar auch Moderna in der EU produziert, wir aber von dem BioNTech-Impfstoff fast doppelt so viel bekommen werden. Die Europäische Kommission hat sich bei Moderna 160 Millionen Impfdosen gesichert, bei BioNTech rund 300 Millionen Dosen.“ Dies erklärte der gesundheitspolitische Sprecher der größten Fraktion im Europäischen Parlament (EVP-Christdemokraten) Dr. med. Peter Liese. Liese führte aus, dass die Prüfung durch die Europäische Arzneimittelagentur einige Wochen dauern wird und bittet alle Beteiligten um Geduld.
- Details
Einige Woche gründliche Prüfung als überhastetet Impfbeginn / Krisenmanagement in Großbritannien eines der schlechtesten weltweit
„Ich halte diese Entscheidung für problematisch und empfehlen den EU-Mitgliedstaaten diesem Beispiel nicht zu folgen. Einige Wochen gründliche Prüfung durch die Europäische Arzneimittelagentur (EMA) sind besser als eine überhastete Notfallzulassung.“ Dies erklärte der gesundheitspolitische Sprecher der größten Fraktion im Europäischen Parlament (EVP-Christdemokarten), Dr. med. Peter Liese anlässlich der erteilten Notfallzulasung des Coronaimpfstoffes von Biontech/Pfizer im Vereinigten Königreich.
Liese betonte, dass die Entscheidung formal nichts mit dem Brexit zu tun habe. Alle EU-Mitgliedssatten haben nach den europäischen Regeln, an die Großbritannien auch noch bis Ende des Jahres gebunden ist, die Möglichkeit, in bestimmten Fällen national eine Notfallzulassung zu erteilen.
„Deutschland und andere Länder tun dies aber nicht, weil sie glauben, dass eine sorgfältige Prüfung durch die Europäische Arzneimittelagentur den Menschen zusätzliche Sicherheit geben wird.
- Details
Zügige Prüfung, aber keine hastige Prüfung / Zulassung innerhalb von Wochen und nicht innerhalb von ein bis zwei Tagen
Der gesundheitspolitische Sprecher der größten Fraktion im Europäischen Parlament (EVP-Christdemokraten) Dr. med. Peter Liese unterstützt das Zulassungsverfahren für Impfstoffe in der Europäischen Union. Im Gegensatz zu der Regelung in den USA und dem Vorgehen in Großbritannien wird die Europäische Union keine Notfallzulassung für Impfstoffe durchführen. „Die 27 Mitgliedstaaten der Europäischen Union hätten die Möglichkeit, genau wie Großbritannien eine Notfallzulassung zu beantragen. Dies ist Großbritannien trotz Brexit auch nur deshalb möglich, weil es eine entsprechende Regelung in der EU-Gesetzgebung gibt. Jedes andere Mitgliedsland könnte dies auch tun, ich empfehle es aber nicht. Das Prüfverfahren bei der Europäischen Arzneimittelagentur ist seriöser, weil sich dort Experten aus allen Mitgliedstaaten treffen, und die Daten genauer analysiert werden als bei den nationalen Notfallzulassungsverfahren.